Reaksi-reaksi dalam Larutan Elektrolit
Ditulis pada: 11/02/2016
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena kandungan ion-ion di dalamnya. Pada larutan elektrolit kuat terdapat komponen zat-zat terlarut dalam kandungan ion-ion hasil proses ionisasi. Jika dua macam larutan elektrolit direaksikan, maka terjadi reaksi antara ion-ion yang terdapat di dalamnya sehingga disebut reaksi ion.
Zat-zat yang larut dalam air akan menghasilkan larutan elektrolit sebagai berikut.
#1. Asam. Berdasarkan definisi Arrhenius jika dilarutkan dalam air akan menghasilkan ion H+ dan sisanya disebut ion sisa asam atau anion asam.
Zat-zat yang larut dalam air akan menghasilkan larutan elektrolit sebagai berikut.
#1. Asam. Berdasarkan definisi Arrhenius jika dilarutkan dalam air akan menghasilkan ion H+ dan sisanya disebut ion sisa asam atau anion asam.
#2. Basa. Jika dilarutkan dalam air akan menghasilkan ion OH- (Hidroksida) dan kation basa yang berupa ion-ion logam atau ion-ion positif, seperti ion amonium.
#3. Oksida. Yaitu senyawa antara suatu unsur dengan unsur oksigen. Oksigen dapat membentuk larutan elektrolit jika dilarutkan dalam air karena terbentuk asam atau basa. Berdasarkan sifat ini oksida dapat dibagi menjadi oksida asam, oksida basa, oksida amfoter, dan oksida indiferen.
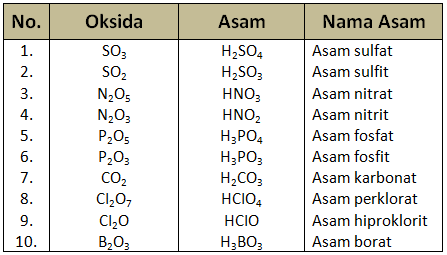
- Oksida asam adalah senyawa oksida yang dapat bereaksi dengan air meghasilkan larutan yang bersifat asam. Oksida asam merupakan senyawa-senyawa oksida nonlogam.Tabel Contoh Oksida Asam
- Oksida basa adalah senyawa oksida yang dapat bereaksi dengan air menghasilkan larutan bersifat basa.Tabel Contoh Oksida Basa

- Oksida amfoter adalah senyawa oksida yang bereaksi dengan larutan asam bersifat basa, tetapi jika bereaksi dengan larutan basa bersifat sebagai asam.Tabel Contoh Oksida Amfoter
- Oksida indiferen adalah oksida yang tidak dapat bereaksi dengan air. Contohnya CO, MNO2, dan NO.
#4. Garam, jika dilarutkan dalam air akan menghasilkan ion-ion yang terdiri atas kation basa dan anion asam. Misalnya, garam dapur (NaCl) jika dilarutkan dalam air akan terionisasi menghasilkan ion Na+ dan ion Cl-. Ion Na+ merupakan kation basa natium hidroksida dalam ion Cl- merupakan anion asam klorida. Garam dapat terbentuk dari beberapa macam reaksi dalam larutan elektrolit. Setiap reaksi yang menggabungkan ion positif dari basa dan ion negatif dari asam akan menghasilkan garam. Beberapa macam reaksi yang menghasilkan garam disebut sebagai reaksi penggaraman.
Asam dan basa bereaksi membentuk senyawa ion yang kita sebut garam. Garam yang terbentuk terdiri atas kation basa dan anion sisa asam. Macam-macam reaksi dalam larutan asam dan basa sebagai berikut.
- Reaksi Penetralan
Reaksi penetralan adalah reaksi asam dan basa menghasilkan garam. Persamaan reaksi secara umum yaitu sebagai berikut.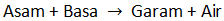
Contoh: reaksi antara asam sulfat dan kalium hidroksida
- Reaksi Oksida Basa dengan Asam
Oksida basa adalah oksida logam yang dapat bereaksi dengan asam membentuk garam dan air.
Reaksi terjadi karena ion H+ asam bereaksi dengan ion O2 daru oksida basa membentuk air. Misalnya reaksi antara kalsium oksida dan asam klorida berikut ini.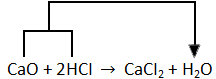
- Reaksi Oksida Asam dengan Basa
Oksida asam adalah oksida nonlogam yang dapat bereaksi dengan basa menghasilkan garam dan air.
Reaksi terjadi karena ion OH- basa bereaksi dengan oksida asam membentuk anion sisa asam dan air. Misalnya, reaksi antara gas, karbon dioksida dengan basa berikut ini. - Reaksi Amonia dengan Asam
Reaksi amonia dengan asam membentuk garam amonium.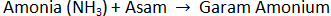
Reaksi terjadi karena ion H+ dari asam bergabung dengan molekul amonia membentuk ion amonium (ingat, NH3 adalah suatu basa Bronsted Lowry). - Reaksi Logam dengan Asam Kuat Encer
Reaksi logam dengan asam kuat (HCl dan H2SO4) encer menghasilkan garam dan gas hidrogen.
Semua logam, kecuali tembaga, raksa, perak, emas, dan platina, larut dalam asam kuat (HCl atau H2SO4) encer membentuk garam dan gas hidrogen.
Demikian pembahasan mengenai reaksi dalam larutan elektrolit ini, semoga artikel ini bisa bermanfaat dan menambah wawasan anda.